去年一年,虽说阿尔兹海默病(AD)的药物失败了好几个,不过人们对它认识还是前进了不少。比如发现tau蛋白的作用一直搞反了、神经中淀粉样蛋白前体蛋白还会基因重组。其中最重要的恐怕还是疱疹病毒可能是导致AD的病因之一。
这一发现有力地支持了AD病因的感染假说,那其它病原体的感染会不会也有可能和AD的发生有关呢?
近日,贝勒医学院的WuYifan和DavidCorry等研究发现,白色念珠菌,一种十分常见,时不时还会引起口腔溃疡的真菌,可以轻易通过血脑屏障,造成大脑皮层无症状感染,形成与AD斑块相似的胶质肉芽肿,并造成短暂的记忆障碍。相关研究发表在NatureCommunication上[1]。
白色念珠菌也叫白假丝酵母,广泛存在于人体的皮肤黏膜上,是皮肤黏膜正常菌群的一员。但在免疫力低下时,白色念珠菌就要出来刷刷存在感了。像很多人都不在意的口腔溃疡,常常就是白色念珠菌引起的。严重的时候,白色念珠菌甚至有可能侵入血液,造成侵袭性念珠菌病(这种情况多发生在住院病人中,尤其是ICU)[2]。
所谓趁你病要你命。这些病人本身抵抗力就差,再来个念珠菌感染,哪怕是在医疗条件相对发达的美国,住院儿童和成人的死亡率也会因此增加10.0%和14.5%,平均每年造成10亿美元的经济损失[3]。
而且念珠菌似乎还特别容易影响大脑。在尸检中,念珠菌感染一直是真菌性脑脓肿最常见的病因,没有之一[4]。流行病学也显示,白色念珠菌感染可能和多种精神疾病也有关系[5]。
平时没啥存在感的白色念珠菌竟然能造成如此严重的结果!这也让WuYifan和DavidCorry决定好好研究一下念珠菌的感染,特别是其对大脑的影响。
研究人员按照前人的方法[5],通过静脉注射白色念珠菌构建了小鼠模型。为了避免小鼠大量死亡,并更准确的模拟更为常见的短期无症状感染,研究人员还特意把注射的菌数从10万~100万降低到了2.5万。
这种条件下,白色念珠菌依然轻松通过了血脑屏障。在接种4天后,小鼠大脑中检出了白色念珠菌,一直持续到接种后第10天。不过在这一过程中,小鼠没有出现任何发热、低体温或行为异常,更没有死亡发生。小鼠脑中的白色念珠菌也始终保持酵母形态,没有转化成更具侵袭性的菌丝体。
精神方面,这种短暂轻微的白色念珠菌感染也没有造成任何异常,只是受感染的小鼠在T型迷宫中的表现略差,工作空间记忆能力受到了一定的影响。在感染清除后,小鼠的记忆能力也恢复了正常。
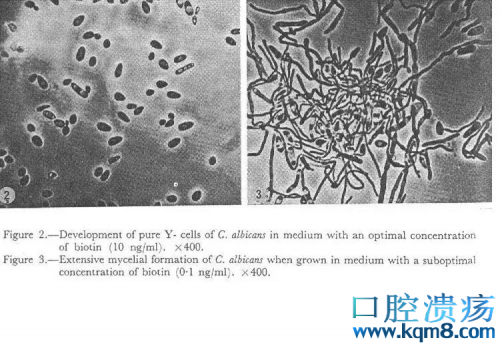
酵母形态(左)和菌丝形态(右)的白色念珠菌
接下来,研究人员在接种白色念珠菌4天后处死小鼠,切片观察了它们的脑组织。在这些小鼠的大脑皮层中,研究人员发现了许多散在的大致球形的病灶,直径在50~200μm左右。
荧光染色显示,这些病灶的中心聚集了大量的白色念珠菌,而周围则包绕着星形胶质细胞和小胶质细胞。研究人员将这种病灶命名为真菌诱导的胶质肉芽肿(FIGG)。
在FIGG中,研究人员观察到了跟免疫有关的NF-κB信号通路的激活,小胶质细胞的活化和增殖,以及IL-1β、IL-6、TNF等多种细胞因子的分泌。特别是淀粉样蛋白前体(APP)和β淀粉样蛋白(Aβ)的水平,在FIGG中也升高了。这些现象,在AD斑块中同样存在。
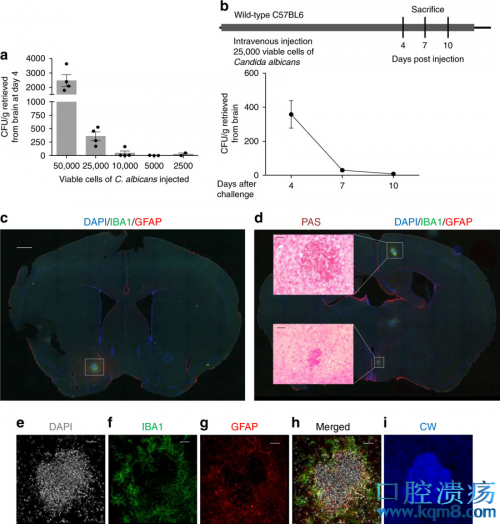
FIGG中的细胞核(左1)、小胶质细胞(左2)、星形胶质细胞(中)和白色念珠菌(右1)
在FIGG中,高表达APP的区域主要是核心区周围的胶质细胞增生区,而Aβ却主要集中在FIGG中心,和其中的白色念珠菌直接接触。
此前,有研究显示Aβ可能是中枢神经系统中的抗菌斗士,或许在这里,与真菌直接接触的Aβ也是来抗感染的?
研究人员在APP缺失小鼠和过表达的小鼠中进行了试验。确实,缺少了APP的小鼠,清除大脑中白色念珠菌的能力下降了,而过表达APP的小鼠,清除能力显著增强。
进一步的研究发现,Aβ一方面刺激小胶质细胞产生了一种可溶性抗真菌物质,另一方面也增强了小胶质细胞的吞噬能力。
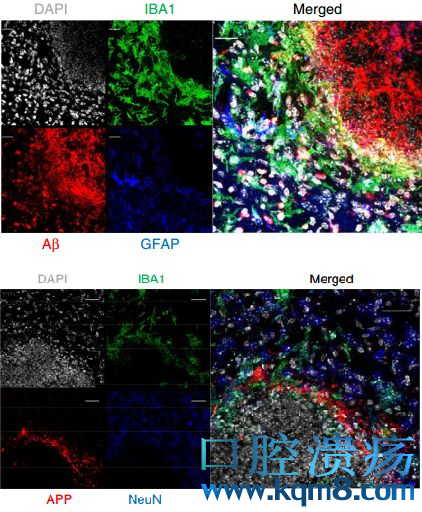
Aβ(上)主要存在于FIGG中心区内,而APP(下)在中心区周围
值得注意的是,Aβ聚集,以及小胶质细胞活化等炎症反应,在AD斑块中同样存在[7],而试验中的小鼠也出现了短暂的记忆力下降。
虽说感染清除后,小鼠的记忆力很快恢复了,而且FIGG中的Aβ主要是可溶的,但可以想象,如果这样的轻度感染反复发生,是有可能造成Aβ沉积,导致永久性脑损伤和认知障碍的。
在以往的研究中也发现,AD患者的大脑中存在真菌[8],以及用来水解真菌细胞壁的几丁质酶[9]。而与真菌有关的过敏性哮喘,也与痴呆风险升高有关[10]。
论文通讯作者Corry表示:“这些发现表明,真菌在人类疾病中的作用可能远远超出过敏性气道疾病和败血症。研究结果促使我们考虑,在某些情况下,真菌也可能参与慢性神经退行性疾病的发展,如阿尔茨海默病、帕金森病和多发性硬化症。我们目前正在探索这种可能性。”
编辑神叨叨
这个研究还有很多地方没搞清楚,比如白色念珠菌是怎么突破血脑屏障的,包括反复感染导致AD,其实也没最终证实,但确实提示了这种可能性的存在。期待后续的研究。
更多肿瘤治疗新进展尽在瞬息:
参考文献:
1. WuY,DuS,JohnsonJL,etal.MicrogliaandamyloidprecursorproteincoordinatecontroloftransientCandidacerebritiswithmemorydeficits[J].NatureCommunications,2019,10(1):58.DOI: 10.1038/s41467-018-07991-4
2. GowNAR,YadavB.Microbeprofile:Candidaalbicans:ashape-changing,opportunisticpathogenicfungusofhumans[J].Microbiology,2017,163(8):1145-1147. DOI:10.1099/mic.0.000499
3. ZaoutisTE,ArgonJ,ChuJ,etal.TheepidemiologyandattributableoutcomesofcandidemiainadultsandchildrenhospitalizedintheUnitedStates:apropensityanalysis[J].Clinicalinfectiousdiseases,2005,41(9):1232-1239. DOI:10.1086/496922
4. PendleburyWW,PerlDP,MunozDG.Multiplemicroabscessesinthecentralnervoussystem:aclinicopathologicstudy[J].JournalofNeuropathology&ExperimentalNeurology,1989,48(3):290-300.DOI: 10.1097/00005072-198905000-00006
5. SeveranceEG,GressittKL,StallingsCR,etal.Candidaalbicansexposures,sexspecificityandcognitivedeficitsinschizophreniaandbipolardisorder[J].npjSchizophrenia,2016,2:16018. DOI:10.1038/npjschz.2016.18
6. LionakisMS,LimJK,LeeCCR,etal.Organ-specificinnateimmuneresponsesinamousemodelofinvasivecandidiasis[J].Journalofinnateimmunity,2011,3(2):180-199. DOI:10.1159/000321157
7. Wyss-CorayT.InflammationinAlzheimerdisease:drivingforce,bystanderorbeneficialresponse?[J].Naturemedicine,2006,12(9):1005. DOI:10.1038/nm1484
8. AlonsoR,PisaD,MarinaAI,etal.FungalinfectioninpatientswithAlzheimer'sdisease[J].JournalofAlzheimer'sDisease,2014,41(1):301-311. DOI:10.3233/JAD-132681
9. SanfilippoC,MalaguarneraL,DiRosaM.ChitinaseexpressioninAlzheimer'sdiseaseandnon-dementedbrainsregions[J].Journaloftheneurologicalsciences,2016,369:242-249. DOI:10.1016/j.jns.2016.08.029
10. RusanenM,NganduT,LaatikainenT,etal.Chronicobstructivepulmonarydiseaseandasthmaandtheriskofmildcognitiveimpairmentanddementia:apopulationbasedCAIDEstudy[J].CurrentAlzheimerresearch,2013,10(5):549-555.